Leishmaniose
Leishmaniose | |
|---|---|
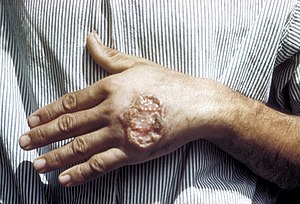 Úlcera de leishmaniose cutânea na mão de um adulto. | |
| Sinónimos | Leishmaníase |
Especialidade | Infectologia |
| Sintomas | Úlceras na pele, febre, diminuição dos glóbulos vermelhos, aumento de volume do fígado[1][2] |
| Causas | Parasitas Leishmania transmitidos sobretudo por flebotomíneos[1] |
| Prevenção | Redes mosquiteiras, insecticida[1] |
| Frequência | 4–12 milhões[3][4] |
| Mortes | 24 200 (2015)[5] |
| Classificação e recursos externos | |
CID-10 | B55 |
CID-9 | 085 |
DiseasesDB | 3266 29171 3266 7070 |
MedlinePlus | 001386 |
eMedicine | emerg/296 |
MeSH | D007896 |
Leishmaniose é uma doença infecciosa causada por protozoários parasitários do tipo Leishmania transmitidos pela picada de insetos da subfamília dos flebotomíneos.[6][1] Existem três tipos principais: leishmaniose cutânea, leishmaniose mucocutânea e leishmaniose visceral.[1] O sintoma mais evidente da forma cutânea são úlceras na pele. Na forma mucocutânea, as úlceras afetam não só a pele como também a boca e nariz. O sintoma inicial da forma visceral são úlceras na pele, a que mais tarde acresce febre, diminuição do número de glóbulos vermelhos e aumento de volume do baço e fígado.[1][2]
As infeções em seres humanos são causadas por mais de 20 espécies de Leishmania.[1] O parasita é transmitido pela picada de mosquitos fêmea de algumas espécies de flebotomínios. No Velho Mundo, o vetor mais comum são espécies do género Phlebotomus, enquanto no Novo Mundo é transmitida exclusivamente por espécies do género Lutzomyia.[7] Entre os fatores de risco estão a pobreza, a desnutrição, desmatamento e urbanização.[1] Os três tipos podem ser diagnosticados mediante observação do parasita ao microscópio.[1] O diagnóstico da forma visceral pode ser feito por meio de análises ao sangue.[2]
A leishmaniose pode ser em parte prevenida dormindo protegido por redes mosquiteiras tratadas com insecticida.[1] Entre outras medidas estão o uso de insecticida para matar o mosquito-palha e tratar imediatamente as pessoas com a doença para evitar que transmitam novamente a doença.[1] O tratamento depende do local onde foi adquirida a doença, da espécie de Leishmania e do tipo de infeção.[1] Entre os medicamentos usados para tratar a leishmaniose visceral estão a anfotericina B lipossómica,[8] a associação de antimónio pentavalente e paromomicina,[8] e a miltefosina.[9] Entre os medicamentos usados no tratamento das formas cutâneas estão a paromomicina, fluconazol e a pentamidina.[10]
Estima-se que atualmente estejam infetadas com a doença entre 4 e 12 milhões de pessoas[3][4] em 98 países.[2] Todos os anos ocorrem dois milhões de novos casos[2] e entre 20 a 50 mil mortes.[1][11] Cerca de 200 milhões de pessoas vivem em regiões da Ásia, África, América Central e do Sul e Europa do Sul onde a doença é comum.[2][12] A Organização Mundial de Saúde fornece medicamentos para o tratamento da doença a custo reduzido.[2] A leishmaniose está classificada como doença tropical negligenciada.[13] A doença pode também ocorrer numa série de outros animais, incluindo cães e roedores.[1]
Índice
1 Classificação
1.1 Leishmaniose visceral
1.2 Leishmaniose cutânea
1.3 Leishmaniose mucocutânea
2 Sinais e sintomas
3 Causas
3.1 Organismos
3.2 Vetores
4 Prevenção
5 Diagnóstico
6 Tratamento
7 Epidemiologia
8 Imagens adicionais
9 Ver também
10 Referências
Classificação |
Leishmaniose visceral |
A leishmaniose visceral (LV), também conhecida como calazar e febre negra, é a forma mais severa de leishmaniose. É a terceira maior doença letal parasitária, depois da malária e da amebíase. Estima-se que cause 60.000 e até 2 milhões mortes por ano no mundo. O parasita migra para os órgãos viscerais como fígado, baço e medula óssea e, caso se desenvolva a doença e não sendo feito tratamento adequado, quase sempre resultará na morte do hospedeiro. Sinais e sintomas incluem febre, perda de peso, anemia e inchaço significativo do fígado e do baço. De acordo com a Organização Mundial de Saúde (OMS), é o problema emergente da co-infecção HIV/LV, mas que tem vindo a ser reduzido devido a terapias eficazes para a infeção com HIV.
Em hospedeiros humanos, a resposta à infecção por L. donovani varia bastante, não só pela força mas também pelo tipo da reação imune do paciente. Pacientes que produzem números grandes de células-T do tipo TH1, que ativa a resposta celular mas não encorajam a formação de anticorpos, frequentemente recuperam-se da infecção e depois são imunes a uma reinfecção. Pacientes cujos sistemas imunitários produzem mais células do tipo TH2, que promovem apenas a formação de anticorpos, são mais afetados.

Ultrassonografia evidenciando hepatomegalia em paciente diagnosticado com leishmaniose visceral.
Na leishmaniose visceral humana, os primeiros sintomas podem ser associados ao descamamento da pele - com destaque para regiões em torno do nariz, boca, queixo e orelhas, sendo frequentes também no couro cabeludo, onde estes são geralmente confundidos com caspa; e ao aparecimento de pequenos calombos semiesféricos sob o couro cabeludo, geralmente sensíveis ao toque. Tais calombos surgem e desaparecem com frequência sem contudo implicarem, de forma geral mas não restritiva, feridas. Não obstante, por incômodo, estes podem evoluir para lesões mediante traumas induzidos pelas unhas ou mãos do próprio paciente; tais lesões geralmente cicatrizam-se, contudo, de forma normal. Alterações nos níveis de ácido úrico que não associam-se adequadamente às causas típicas desta anomalia - a exemplo bem notórias mesmo em pacientes vegetarianos - e que acabam por implicar sintomas muito semelhantes aos da gota - bem como alterações na quantificação de enzimas associadas ao fígado - como a gama glutamil transferase e transaminase pirúvica - passam a ser detectáveis em exames de sangue. Com a evolução da doença os sintomas mais típicos incluem o aumento do baço ou esplenomegalia, sendo este geralmente também acompanhado do aumento do fígado ou hepatomegalia, ambos detectáveis via ultrassonografia. Se deixada sem tratamento, a doença evolui para um quadro crítico caracterizado por rápido e intenso emagrecimento, dor abdominal, ausência de apetite, apatia e febre alta, intermitente e crônica - com duração superior a dez dias - fase na qual o paciente geralmente é levado a procurar o médico. Nesta fase os hemogramas geralmente revelam, entre outras anomalias, os níveis de albumina e contagem de leucócitos significativamente alterados, sendo notórias a anemia e a leucopenia. A mortalidade da doença nesta etapa é consideravelmente aumentada por estes sintomas serem facilmente confundidos com os de outras patogenias; nesta fase, se deixada sem tratamento, a doença quase sempre implica a morte do paciente. O escurecimento da pele, que deu à doença seu nome comum na Índia, não aparece na maioria dos casos de doença, e os outros sintomas são muito fáceis de confundir com os da malária. O erro no diagnóstico é perigoso, pois, sem tratamento, a taxa de mortalidade para kala-azar está próxima a 100%.
Humanos e outros animais infectados são considerados reservatórios da doença, uma vez que o flebótomo, ao sugar o sangue destes, pode transmiti-lo a outros indivíduos ao picá-los. Na LV causada por L. infantum os humanos não são considerados reservatórios, pelo menos significativos. Em região rural e de mata, as raposas e cães não domésticos são os principais reservatórios, havendo suspeitas que os roedores também o podem ser; no ambiente urbano, os cães são o principal reservatório. Nem todos os cães, quando infectados, apresentam os sinais da doença (emagrecimento, perda de pelos e lesões na pele). Na LV causada por L. donovani no sub-continente Indiano a doença é considerada como antroponose.
Algum tempo depois do tratamento pode surgir uma forma secundária da [doença], chamada leishmaniose dérmica pós-kala-azar ou LDPK. Esta condição se manifesta primeiro como lesões de pele na face que gradualmente aumentam em tamanho e espalham-se pelo corpo. Eventualmente as lesões podem ser desfigurantes, deixando cicatrizes semelhantes a lepra e causando cegueira ocasionalmente se atingirem os olhos. Esta forma é principalmente observada em pacientes infetados com L. donovani em África e na Ásia.
Leishmaniose cutânea |
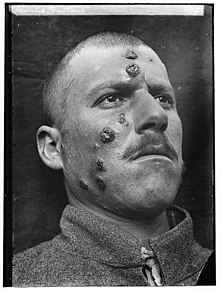
Forma cutânea de leishmaniose, dita "de Jericó", dada a sua frequência na região de Jericó.
Leishmaniose cutânea é a forma mais comum de leishmaniose. É uma infecção de pele causada por um parasita unicelular que é transmitida pelas picadas de insetos flebótomos. Há aproximadamente 20 espécies de Leishmania que podem causar leishmanioses cutâneas.
Leishmaniose mucocutânea |
A leishmaniose mucocutânea é a mais temida forma de leishmaniose cutânea porque produz lesões destrutivas das mucosas e cartilagens, assim desfigurando a face. É causada frequentemente por Leishmania (Viannia) braziliensis e outras espécies do sub-género Leishmania (Viannia), mas são descritos raramente casos provocados por L. aethiopica.
O tratamento para a leishmaniose mucocutânea é difícil e baseia-se na combinação de pentoxifilina e um antimônio pentavalente em dosagens altas durante 30 dias: isto alcança taxas de cura de 90%. Tratamento só com antimônio pentavalente não cura 42% dos pacientes, até mesmo naqueles que alcançam uma cura aparente, 19% recairá.
Sinais e sintomas |
Uma infecção por leishmanias pode tomar dois cursos. Na maioria dos casos o sistema imunitário reage eficazmente pela produção de uma resposta citotóxica (resposta Th1) que destrói os macrófagos portadores de leishmanias. Nestes casos a infecção é controlada e os sintomas leves ou inexistentes, curando-se o doente ou desenvolvendo apenas manifestações cutâneas. No entanto, se o sistema imunitário escolher antes uma resposta (humoral ou Th2) com produção de anticorpos, não será eficaz a destruir as leishmanias que se escondem no interior dos macrófagos, fora do alcance dos anticorpos. Nestes casos a infecção (apenas L. donovani irá se desenvolver em leishmaniose visceral), uma doença grave, ou no caso das espécies menos virulentas, para manifestações mucocutâneas mais agressivas e crónicas. Um indivíduo imunodeprimido não reage com nenhuma resposta imunitária eficaz, e estes, especialmente os doentes com SIDA/AIDS, desenvolvem progressões muito mais perigosas e rápidas com qualquer dos patogénios. Em Portugal, Espanha, Itália e França este grupo tem ultimamente formado uma percentagem grande dos doentes com formas de leishmaniose graves.
A leishmaniose visceral, também conhecida por kala-azar ou febre dumdum, tem um período de incubação de vários meses a vários anos. As leishmanias danificam os órgãos ricos em macrófagos, como o baço, o fígado, e a medula óssea. Os sintomas mais comuns do kala azar são[14]:
Febre prolongada,
Úlceras escuras na pele- Aumento do baço (esplenomegalia),
- Aumento do fígado (hepatomegalia),
Leucopenia,
Anemia,- Hipergamaglobulinemia,
Tosse,
Dor abdominal,
Diarreia,- Perda de peso e;
caquexia.
Outros sintomas possíveis são tremores violentos, diarreia, suores, mal estar e fadiga.[carece de fontes] As manifestações cutâneas são denominadas como kala azar, "doença preta" em hindi e persa, ou como "botão de Jericó". Se não tratada, pode ser fatal num período curto ou após danos crónicos durante alguns anos, especialmente em pessoas com SIDA/AIDS. O diagnóstico certo é difícil, pois vários desses sintomas também são encontrados na doença de Chagas, malária, esquistossomose, febre tifoide e tuberculose, doenças comuns nas áreas endêmicas da Leishmaniose visceral.[14]
A leishmaniose cutânea tem uma incubação de algumas semanas a alguns meses (geralmente) assintomáticos, após o qual surgem sintomas como lesões na pele (pápulas ulcerantes) extremamente irritantes nas zonas picadas pelo mosquito, que progridem para crostas com líquido seroso. Há também escurecimento por hiperpigmentação da pele, com resolução das lesões em alguns meses com formação de cicatrizes desagradáveis. A leishmaniose mucocutânea é semelhante mas com maiores e mais profundas lesões, que se estendem às mucosas da boca, nariz ou genitais.
Causas |
Organismos |

Leishmania donovani numa célula de medula óssea
A leishmania é um protozoários parasita de células do sistema fagocítico mononuclear de mamíferos, especialmente de macrófagos. As formas promastigotas (infecciosas) são alongadas e possuem um flagelo locomotor anterior, que utilizam nas fases extracelulares do seu ciclo de vida. O amastigota (intracelular) possui um flagelo rudimentar.
Há cerca de 30 espécies patogênicas para o ser humano (CDC). As mais importantes são:
- As espécies L. donovani, L. infantum infantum, e L. infantum chagasi que podem produzir a leishmaniose visceral, mas, em casos leves, apenas manifestações cutâneas.
- As espécies L. major, L. tropica, L. aethiopica, L. mexicana, L. braziliensis, L. amazonensis e L. peruviana que produzem a leishmaniose cutânea ou, no caso de L. braziliensis e L. peruviana, a mais grave, mucocutânea.
- Leishmaniose principalmente visceral (organismos mais agressivos):
L. donovani é a mais frequente causa de leishmaniose visceral. Em algumas regiões (Índia Paquistão, Bangladesh e Sudão) encontra-se uma forma de leishmaniose dérmica pos-kalazar (PKDL). É transmitida por Phlebotomus e existe no subcontinente indiano e na África equatorial (desconhecida em Angola e Moçambique). O reservatório são os seres humanos, sendo os cães infetados no Sudão e possíveis reservatórios.
L. infantum infantum provoca uma variante menos grave da leishmaniose visceral e existe na região mediterrânica, incluindo países do Norte de África, Turquia, Israel, Grécia, Itália, sul da França, Portugal e Espanha e ainda nos Balcãs, Irão, algumas regiões da China e Ásia central. É transmitida por Phlebotomus e o seu reservatório são os cães, lobos e raposas. Em Portugal é mais frequente em regiões como Trás-os-Montes, Coimbra e a Beira Litoral, Algarve e na região dos estuários dos rios Sado e Tejo.
L. infantum chagasi existe na América Latina, incluindo Brasil. O inseto transmissor é o flebotomíneo Lutzomyia. Reservatórios: cães e gambás. Esta espécie é considerada uma subespécie de L. infantum.
- Leishmaniose principalmente cutânea (organismos de virulência baixa):
L. major: Norte de África, Médio Oriente e Ásia Central. Transmitida por Phlebotomus, principalmente P. papatasi. Reservatório: roedores. Responsável por produzir ulcerações úmidas, de evolução rápida.
L. aethiopica: Existe na Etiópia e no Quénia. Transmitida por Phlebotomus. Reservatório: Hyrax, espécies de pequenos mamíferos.
L. tropica: Existe em países da costa Sul e Leste do Mediterrâneo e no Médio Oriente. Transmitida por Phlebotomus. O reservatório é principalmente humano (antroponose), mas o Hyrax também foi incriminado em alguns foci.
L. mexicana: encontra-se no México, na Guatemala e Belize. Transmissão por espécies do género Lutzomyia. O reservatório são roedores e marsupiais. Gera úlceras benignas na pele.
L. amazonensis: América do Sul. Transmissão por espécies do género Lutzomyia. O reservatório são os roedores. Produz lesões cutâneas, às vezes múltiplas.
- Leishmaniose principalmente mucocutânea (virulência intermédia):
L. braziliensis: existe em todo o Brasil, Venezuela, Colômbia e Guianas. Transmissão por espécies do género Lutzomyia. Reservatório: roedores e gambás. Caracteriza-se por formar úlceras cutâneas (raramente múltiplas), expansivas e persistentes, frequentemente acompanhadas de lesões graves da nasofaringe.
L. peruviana: predomina nos países andinos, Bolívia, Peru, Equador, Colômbia e Venezuela. Reservatório: cães.
Vetores |

Mosquito flebotomíneo

Os parasitas são transmitidos pela picada dos insetos dípteros dos géneros Phlebotomus na Europa, Ásia e África e Lutzomyia nas Américas. Em Portugal a leishmaníase visceral por L. infantum infantum é transmitida por Phlebotomus perniciosus e Phlebotomus ariasi.
As formas promastigotas metacíclicas (flageladas e móveis) são inoculadas na pele junto com a saliva de flebotomíneos no momento do repasto sanguíneo. São fagocitadas por células do sistema fagocítico mononuclear, principalmente macrófagos, que migraram para o local da infecção. Quando fagocitadas, estas promastigotas se diferenciam em amastigotas dentro dos vacúolos parasitóforos. Os parasitos que não são eliminados pela célula hospedeira, se multiplicam por divisão binária. Quando o macrófago está repleto de parasitos, ele se rompe e libera as formas amastigotas que irão infectar outros macrófagos.
Os flebotomíneos são cruciais na transmissão da leishmaniose visceral, que ocorre quando os insetos se alimentam de humanos ou animais infectados. A seguir, o crescimento dos flagelados no tubo digestivo do vetor torna-se suficiente para assegurar sua inoculação em hospedeiros susceptíveis.
Se, pouco depois de infectar-se, o flebotomíneo volta a alimentar-se com sangue, o crescimento dos flagelados pode ser inibido. Mas se a segunda refeição for feita com sucos de plantas (ou, nas condições de laboratório, com passas ou soluções açucaradas), as formas promastigotas multiplicar-se-ão abundantemente no tubo digestivo do inseto. Quando ele ingere novamente sangue, poderá regurgitar grumos de formas promastigotas infectantes (metacíclicas) que se concentram na válvula estomodial.
Em vista do tempo requerido para o crescimento abundante dos flagelados e da vida curta dos insetos adultos (cerca de duas semanas ou pouco mais), é necessário que o flebotomíneo se infecte muito cedo, talvez por ocasião de suas primeiras refeições sanguíneas, para que possa efetuar a transmissão do calazar.
A proporção de insetos encontrados com infecção natural é sempre muito baixa. Assim, a transmissão fica na dependência de existir, como por exemplo nos focos americanos, uma densidade grande de Lutzomyia longipalpis, fato que se constata nas áreas de leishmaniose visceral, mesmo no interior das casas, sempre que haja um surto epidêmico.
Outro mecanismo de transmissão possível, entre os animais, é a transmissão direta, sem flebotomíneos. Em certas áreas endêmicas, observou-se a pequena densidade de insetos vetores, raros casos humanos e grande incidência do calazar canino. Como os flebotomíneos aí mostravam poucas tendências em picar os cães, supôs-se que a propagação pudesse ter lugar por contato sexual, tanto mais que em diversas pesquisas pôde-se comprovar o parasitismo da glande e da uretra dos cães por leishmanias.
Prevenção |
A prevenção se faz por redes ou repelentes de insectos, pela construção de moradias humanas a distância superior a 500 metros da mata silvestre e pela erradicação de Phlebotomus/Lutzomyia.
Diagnóstico |
O diagnóstico pode ser feito pela observação direta microscópica dos parasitas em amostras de linfa, sanguíneas (raramente) ou de biópsias de baço, ou pele (no caso de leishmaniose cutânea), após cultura ou por detecção do DNA dos parasitas ou através de testes imunológicos, como ELISA, imunofluorescência, contra-imuno eletroforese ou testes rápidos (rK39). A Reação de Montenegro pode ser usada para detetar infeções passadas.
Tratamento |
O tratamento recomendado para a leishmaniose visceral na Índia, América do Sul e Mediterrâneo é a administração de anfotericina B lipossómica, geralmente em dose única.[2][8] A taxa de cura com uma única dose de anfotericina aparenta ser de 95%.[2] Na Índia, praticamente todas as infeções são resistentes aos antimónios pentavalentes.[2] Em África é recomendada a administração de antimónios pentavalentes em associação com paromomicina.[8] No entanto, estes podem ter efeitos adversos significativos.[2] A miltefosina oral é eficaz contra tanto contra a leishmaniose visceral como cutânea,[9] embora não aparente ser eficaz contra a L. major ou L. braziliensis.[10] Os efeitos adversos da miltefosina são geralmente ligeiros, embora possa causar malformações do feto se tomada no primeiro trimestre da gravidez.[2][9]
Para o tratamento de leishmaniose cutânea podem ser usados uma série de tratamentos de aplicação tópica. A escolha do tratamento depende da estirpe do parasita. A paromomicina de aplicação tópica é eficaz contra infeções por L. major, L. tropica, L. mexicana, L. panamensis e L. braziliensis.[10] A pentamidina é eficaz contra infeções por L. guyanensis.[10] O fluconazol ou itraconazol por via oral aparentam ser eficazes contra infeções por L. major e L. tropica.[2][10] No entanto, as evidências relativas ao tratamento da leishmaniose cutânea são pouco robustas.[2] À data de 2015, algumas evidências apoiavam a utilização de termoterapia em leishmaniose cutânea.[15]
Epidemiologia |
É difícil fazer uma avaliação pois precisa da distribuição global da doença, pois ela é comum em áreas isoladas, muitos dos pacientes escondem a doença e em muitos países ela não é notificada.
Estima-se que a Leishmaniose (cutânea e visceral) no ano de 2003 apresentava uma prevalência de 12 milhões de casos no mundo e que 350 milhões de pessoas viviam nas áreas com risco de contrair a doença. Segundo a OMS, 2 milhões de pessoas são contaminadas todos os anos (1,5 milhões de casos de leishmaniose cutânea e 500 000 casos de leishmaniose visceral). E esse número parece estar aumentando.[16]
Essa doença está espalhada por 88 países, dos quais 72 são países em desenvolvimento. A grande maioria dos casos de Leishmaniose visceral ocorrem no Brasil, Bangladesh, Índia ou Sudão. A grande maioria dos casos de leishmaniose mucocutânea ocorre no Brasil, Bolívia ou Peru. E a maioria dos casos de leishmaniose cutânea ocorrem no Brasil, Afeganistão, Irã, Peru, Arábia Saudita ou Síria. Mais de 90% dos casos ocorrem nesses países, sendo o Brasil o único a reunir grandes números de casos dos 3 tipos de leishmaniose.
Alguns estudos sugerem que a criação de gado ou outros animais pode ser um fator de risco, provavelmente por estes animais serem fonte de alimentação sanguínea para os flebótomos, mas não há evidência de que sejam reservatório da doença.
Imagens adicionais |

Flebotomíneo
Morfologia amastigota

Leishmania tropica

Ferida causada por leishmaniose cutânea
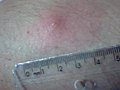
Reação intradérmica de Montenegro. Resultado reagente (após 72 Horas da inoculação).
Ver também |
- Leishmaniose canina
- Leishmaniose no Brasil
Referências
↑ abcdefghijklmn «Leishmaniasis Fact sheet N°375». World Health Organization. Janeiro de 2014. Consultado em 17 de fevereiro de 2014. Cópia arquivada em 21 de fevereiro de 2014
↑ abcdefghijklmn Barrett, MP; Croft, SL (2012). «Management of trypanosomiasis and leishmaniasis.». British Medical Bulletin. 104: 175–96. PMC 3530408 . PMID 23137768. doi:10.1093/bmb/lds031
. PMID 23137768. doi:10.1093/bmb/lds031
↑ ab «Leishmaniasis Magnitude of the problem». World Health Organization. Consultado em 17 de fevereiro de 2014. Cópia arquivada em 26 de outubro de 2013
↑ ab GBD 2015 Disease and Injury Incidence and Prevalence, Collaborators. (8 de outubro de 2016). «Global, regional, and national incidence, prevalence, and years lived with disability for 310 diseases and injuries, 1990-2015: a systematic analysis for the Global Burden of Disease Study 2015.». Lancet. 388 (10053): 1545–1602. PMC 5055577 . PMID 27733282. doi:10.1016/S0140-6736(16)31678-6
. PMID 27733282. doi:10.1016/S0140-6736(16)31678-6
↑ GBD 2015 Mortality and Causes of Death, Collaborators. (8 de outubro de 2016). «Global, regional, and national life expectancy, all-cause mortality, and cause-specific mortality for 249 causes of death, 1980-2015: a systematic analysis for the Global Burden of Disease Study 2015.». Lancet. 388 (10053): 1459–1544. PMC 5388903 . PMID 27733281. doi:10.1016/s0140-6736(16)31012-1
. PMID 27733281. doi:10.1016/s0140-6736(16)31012-1
↑ Pearson, Richard. «Leishmaniose». Manual Merck. Consultado em 11 de dezembro de 2018
↑ David M Claborn (2010). «The Biology and Control of Leishmaniasis Vectors». J Glob Infect Dis. 2 (2): 127–134. PMID 20606968. doi:10.4103/0974-777X.62866
↑ abcd Sundar, S; Chakravarty, J (janeiro de 2013). «Leishmaniasis: an update of current pharmacotherapy.». Expert Opinion on Pharmacotherapy. 14 (1): 53–63. PMID 23256501. doi:10.1517/14656566.2013.755515
↑ abc Dorlo, TP; Balasegaram, M; Beijnen, JH; de Vries, PJ (novembro de 2012). «Miltefosine: a review of its pharmacology and therapeutic efficacy in the treatment of leishmaniasis.». The Journal of Antimicrobial Chemotherapy. 67 (11): 2576–97. PMID 22833634. doi:10.1093/jac/dks275
↑ abcde Minodier, P; Parola, P (maio de 2007). «Cutaneous leishmaniasis treatment.». Travel Medicine and Infectious Disease. 5 (3): 150–8. PMID 17448941. doi:10.1016/j.tmaid.2006.09.004
↑ Lozano, R (15 de dezembro de 2012). «Global and regional mortality from 235 causes of death for 20 age groups in 1990 and 2010: a systematic analysis for the Global Burden of Disease Study 2010.». Lancet. 380 (9859): 2095–128. PMID 23245604. doi:10.1016/S0140-6736(12)61728-0
↑ Ejazi, SA; Ali, N (janeiro de 2013). «Developments in diagnosis and treatment of visceral leishmaniasis during the last decade and future prospects.». Expert Review of Anti-infective Therapy. 11 (1): 79–98. PMID 23428104. doi:10.1586/eri.12.148
↑ «Neglected Tropical Diseases». cdc.gov. 6 de junho de 2011. Consultado em 28 de novembro de 2014. Cópia arquivada em 4 de dezembro de 2014
↑ ab GONTIJO, Célia Maria Ferreira and MELO, Maria Norma. Leishmaniose visceral no Brasil: quadro atual, desafios e perspectivas. Rev. bras. epidemiol. [online]. 2004, vol.7, n.3 [cited 2011-06-14], pp. 338-349 . Available from: <http://www.scielosp.org/scielo.php?script=sci_arttext&pid=S1415-790X2004000300011&lng=en&nrm=iso>. ISSN 1415-790X. doi: 10.1590/S1415-790X2004000300011.
↑ Von Stebut, E (março de 2015). «Leishmaniasis.». Journal der Deutschen Dermatologischen Gesellschaft = Journal of the German Society of Dermatology : JDDG. 13 (3): 191–200; quiz 201. PMID 25721626. doi:10.1111/ddg.12595
↑ «Leishmaniasis»




